Контрольная работа: Колоїдні розчини
Міністерство
освіти і науки України
Нікопольського
Медичного Училища
Самостійна
робота на тему:
"Колоїдні
розчини"
Виготовили:
Рогоза
Анастасія
Ласкіна
Наталія
Олійник
Світлана
Бутко
Яна
Мадай
Анастасія
Кисельова
Вікторія
Зміст
1.
Колоїди та колоїдні системи
2.
Грунтові колоїдни та поглинальна
здатність грунту
3.
Способи одержання колоїдних розчинів
*
Метод конденсації
* Медод гідролізу
* Метод заміни
розчинника
* Електричник метод
* Метод очищення
колоїдних розчинів
*Метод обмінного
розкладу
4. Броунівський рух
5. Броунівський рух у математиці
6. Дифузія
7. Рівняння дифузії
8. Осмотичний тиск
1.
Колоїни та колоїдні системи
Коло́їд,—
речовина, що складається з дуже маленьких часток матерії (дисперсна фаза), які
присутні в іншому матеріалі.
Розмір
дисперсних часток (1-1000 нанометрів, 1 нм = 10-9м) менший, ніж
часток суспензії, але більший за молекули в справжньому розчині.
До колоїдів
відносять аерозолі (дисперсії рідини і твердої речовини в газі, наприклад дим
або туман) і піни (дисперсія газу в рідині), емульсії (обидва компоненти —
рідини) і золі (тверді речовини в рідині). Золі, у яких обидві фази через
тривимірну мережу молекул мають желеподібну форму, називаються гелі, прикладом
можуть бути водні розчини желатину та крохмалю, а також силікатний клей.
КОЛОЇДИ,
КОЛОЇДНІ СИСТЕМИ– мікрогетерогенні дисперсні системи (проміжний стан між
справжніми розчинами й грубо-дисперсними системами), що складаються з дуже
подрібнених частинок (від 1 до 1000 нм), рівномірно розподілених
(розосереджених) в однорідному середовищі або фізично однорідні системи, що
містять макромолекули як один з компонентів (молекулярний колоїд). На відміну
від частинок грубодисперсних систем (суспензій, емульсій, пін тощо), розмір
частинок яких звичайно перевищує 10-4 см, колоїдні частинки беруть
участь в інтенсивному броунівському рухові і не седиментують в полі сил земного
тяжіння. К.с. з газовим дисперсійним середовищем - високодисперсні аерозолі (дими,
тумани), з рідким - золі, латекси, міцелярні розчини, мікроемульсії, з твердого
- системи типу рубінового скла. Колоїдні системи утворюються внаслідок конденсації
(при виділенні колоїдно-дисперсної фази з перенасиченої пари, розчину або
розплаву) або диспергування. Найпоширеніші в природі та техніці колоїдні
системи з рідким дисперсійним середовищем.
2.
Грунтові колоїдни та поглинальна здатність грунту
О.Н.Соколовський (на
фото) – батько українського грунтознавства, засновник і перший директор
Науково-дослідного інституту грунтознавства та агрохімії (тепер національний
науковий центр "Інститут грунтознавства та агрохімії ім.
О.Н.Соколовського"), автор першого підручника українською мовою "Курс
сільськогосподарського грунтознавства" (1934) і "Сельскохозяйственное
почвоведение" (1956).
Досліджуючи склад
і властивості гумусу, він дійшов висновку: "яким би не був хімічний склад
гумусу, головна його властивість – колоїдність". Тому його підручник
починається розділом "Колоїди грунту, їх динаміка і зв'язані з ними
явища". О.Н.Соколовський поділив гумус грунтів на дві
групи: активний і пасивний. Зразок грунту оброблявся 0,1н розчином NaCl; гумус,
який перейшов після обробки до розчину, він назвав активним – ця фракція гумусу
може рухатися по профілю, покривати структурні відокремлення тоненькою плівкою
тощо. Та частина гумусу, яка не переходить (не пептизується) до розчину навіть
після дії натрію (розчину NaCl) на грунтовий зразок, називається пасивною.
Останній вид гумусу має важливе значення для утворення агрономічно-цінної
структури з розміром агрегатів від 0,25 мм до 7-10 мм. Особлива його здатність
– забезпечення водостійкості структури, тобто здатності не руйнуватися під дією
дощової води. Отже, О.Н.Соколовський обгрунтував роль і значення у
грунтоутворюючих процесах активного і пасивного гумусу або активних і пасивних
колоїдів у житті грунту.
3.
Способи одержання колоїдних розчинів
колоїдний
дифузія броунівський осмотичний тиск
Колоїдні
часточки можуть мати різну внутрішню структуру, що істотно позначається на
способах утворення колоїдних розчинів і на їхніх властивостях.
Існують такі три
типи внутрішньої структури первинних часточок колоїдних розмірів. І тип
— суспензоїди (або необоротні колоїди, ліофобні колоїди). Так
називають колоїдні розчини металів, їхніх оксидів, гідроксидів,
сульфідів та інших солей. Первинні часточки дисперсної фази колоїдних розчинів
цих речовин за своєю внутрішньою структурою не відрізняються від структури
відповідної компактної речовини і мають молекулярну або іонну кристалічну
решітку. Суспензоїди — типові гетерогенні високодисперсні системи, властивості
яких визначаються дуже сильно розвинутою міжфазовою поверхнею. Від суспензій
вони відрізняються вищою дисперсністю. Суспензоїдами їх назвали тому, що, як і
суспензії, вони не можуть тривалий час існувати, коли немає стабілізатора
дисперсності. Необоротними їх називають тому, що осади, які лишаються при
випаковуванні таких колоїдних розчинів, не утворюють знову золю в разі контакту
з дисперсійним середовищем. Ліофобними (з грецького: "ліос" — рідина,
"фобіо" — ненавиджу) їх назвали, гадаючи, що особливі властивості
колоїдних розчинів цього типу зумовлені дуже слабкою взаємодією дисперсної фази
і дисперсійного середовище. Концентрація ліофобних золів невелика, звичайно
менша за 0,1%'. В'язкість таких золів мало відрізняється від в'язкості
дисперсійногосередовища. Ліофобні золі, як взагалі дисперсні системи,
відповідно до їх проміжних положень між молекулами і великими тілами, можна
добути двома способами: диспергуванням, тобто подрібненням великих тіл, і
конденсацією молекулярно- або іоннорозчинених речовин. Подрібнення за допомогою
дроблення, молоття, розтирання дає порівняно крупнодисперсні порошки (> 60
мкм). Більш тонкого подрібнення досягають за допомогою спеціальних апаратів —
колоїдних млинів, або застосовуючи ультразвук.
*
Метод конденсації
Метод
конденсації полягає в утворенні нерозчинних сполук за допомогою реакцій обміну,
гідролізу, відновлення, окислення. Здійснюючи ці реакції в сильно розбавлених
розчинах і з деяким надлишком одного з компонентів, дістають не осади, а колоїдні
розчини. До конденсаційних методів належить також добування ліозолів за
допомогою заміни розчинника. Наприклад, колоїдний розчин каніфолі можна добути,
виливаючи її спиртовий розчин у воду, в якій каніфоль не розчиняється.
II
тип — асоціативні, або міцелярні, колоїди.
Їх називають також напівколоїдами. Колоїдно-дисперсні часточки цього типу
виникають при достатній концентрації дифільних молекул низькомолекулярних
речовин за допомогою асоціації їх в агрегати молекул — міцели — сферичної або
пластинчастої форми.
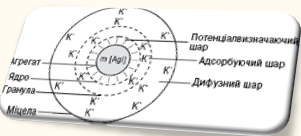
Схема будови
міцели гідрозолю AgI
Міцели
— це скупчення правильно розміщених молекул, що утримуються переважно
дисперсійними силами. Утворення міцел є характерним для водних розчинів миючих
речовин (наприклад, мил — лужних солей вищих жирних кислот) і деяких органічних
барвників з великими молекулами; в інших середовищах, наприклад в етиловому
спирті, ці речовини розчиняються з утворенням молекулярних розчинів.
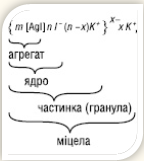
Склад міцели
виражають певною формулою. Напр. склад міцели гідрозолю йодиду срібла,
утвореного при взаємодії нітрату срібла в розчині з надлишком йодиду калію,
виражається формулою:
Дифільними
називають молекули, які складаються з вуглеводневого радикалу, що має
спорідненість до неполярних розчинників, і гідрофільної (полярної) групи, що
має спорідненість до води. III тип — молекулярні коло їди. їх називають
також оборотними, або ліофільними (від грецького "філіо" — люблю),
колоїдами.
До них належать
природні і синтетичні Високомолекулярні речовини з молекулярною масою від
десяти тисяч до кількох мільйонів1. Молекули цих речовин мають розміри колоїдних
часточок, тому такі молекули називають макромолекулами.
*Метод
гідроліза
Гідролізом
широко користуються при одержанні золей із солей, якщо в
результаті
реакції гідроліза утворюється погано розчинна речовина.
В якості приміру
приведем утворення нерозчинного гідрату окисі заліза,яке одрежуємо при
гідролізі хлорного заліза рівнянням:
FeCl3 + 3H2O = Fe(OH)3
+ 3HCl,
Fe(OH)3 + HCl =
FeCl + 2H2O ,
Частково
утворююча в реакції хлор окис заліза дісоціїрує на іоні:
FeОCl = FeO +
Cl,
Які забезпечують
іоноген ний шар навкруги частин Fe(OH)3 і утримують їх
в
рівноваженому стані.
*Методи
заміни розчинника
Метод заснований
на виділення розчинної речовини із розчину в виді високодисперсної нерозчинної
фази шляхом заміни розчинника. Молекули розчинної речі. Яка знаходиться в стані
молекулярної дисперсності в одному розчиннику, попадаючи в умови поганої
розчинності при заміні розчинника починає конденсуватися в більші частинки,
досягаючи розмірів коллоїдних. Цим методом можна користуватись при
приготовленні золя сірки, каніфолі, мастики, фосфору і др. при вливанні
спиртових розчинів цих речовин в воду.
*Електричний
метод
Метод одержання
колоїдних розчинів з допомогою електрики, рекомендований Бредігом (1898 р.),
можна використати головним чином для виготовлення гідрозолей благородних
металів. Цей метод обґрунтований на одержанні електричної дуги між електродами
створеними із диспергіруючого металу (срібла,
золота та ін..) при пропусканні постійного струму. Під дією високої температури
проходить випарування матеріалу електродів в дисперсійному водному середовищі.
Після пари металу конденсуються в колоїдні частинки, утворюючи відповідну золу.
Процес краще проводити при охолодженні.
*Методи
очистки колоїдних розчинів
Для одержання
колоїдних розчинів з найбільшою стійкістю і для вивчення їх якостей необхідно
видалення із золи всяких домішок і в першу чергу остатків електролітів, які, як
правило, утворюються при одержанні колоїдних розчинів.
*Метод обмінного розкладу
Цей метод заснований на взаємодії двох речовин, в результаті реакції обмінного розкладання утворюється нова трудно розчинна річ, здатна зберігатися високодисперсному стані при наявності ряду відповідних умов. Класичним приміром являється одержання зали зернистого миш’яку:
2Н2А5О3 + 3Н2S = А52S3 + 6H2O
або
BaCl2 + K2SO4 = BaSO4 + 2KCl
*Діаліз
Для очистки розчинів широко використовуються метод діаліза. Вилучення колоїдних розчинів від домішок, здатних проникати через рослинні і тваринні, штучні мембрани, називається діалізом, а прибори пристосовані для цього, одержали назву діалізаторів. Перші моделі діалізаторів представляли собою посудину, заповнену проточною водою, в якій поміщалась на глибину декількох сантиметрів внутрішня частина приладу, нагадуючи широкий зрізаний отвір, на більше вузьку частину якої натягаємо мембрану із пергаменту, коллоїда, целофану. У внутрішню частину наливається колоїдний розчин, який треба очистити. З допомогою діалізу поступово проходить видалення речовин,легко проходять черех мембрану, наприклад електролітів і других кристалоїдів. Очистка неколлоїдних розчинів таким способом протікає по мало, і тому для прискорення діаліза використовуємо електричний струм.
4 Молекулярно-кінетичні властивості колоїдних систем (броунівських рух, дифузія, осмотичний тиск)
Бро́унівський рух — невпорядкований, хаотичний рух дрібних частинок речовини в розчинах. Названий на честь ботаніка Роберта Брауна, який спостерігав[1] це явище під мікроскопом у 1827 р.. Теорію броунівського руху побудував у 1905 р. Альберт Ейнштейн.Відкриття й пояснення броунівського руху мало велике значення для фізики, оскільки було свідченням теплового руху молекул. Браун 1827 року відкрив хаотичний рух спор плауна у воді.У броунівському русі вражає одна незвична для нас особливість – рух частинок не припиняється за будь-яких обставин, хоча під час дослідження його причин вживалися запобіжні заходи, які виключали можливість зовнішніх впливів на броунівські частинки. Характер їх руху не змінювався. Отже, причину руху броунівських частинок слід шукати в самій рідині.
Досліди свідчать, що інтенсивність броунівського руху тим більша, чим вища температура рідини, що ще раз підтверджує безпосередній зв’язок броунівського руху з тепловим рухом молекул. Перша кількісна теорія броунівського руху з’явилася у 1905р. Її автором був Альберт Ейнштейнн. Він записав рівняння, яке враховувало хаотичність сили, що діє на броунівську частинку, й, розв'язавши його, отримав співвідношення

де (х2)- середнє значення квадрата зміщення броунівської частинки вздовж осі Х за час t, Т - абсолютна температура рідини, b - коефіцієнт пропорційності, який залежить від розмірів броунівських частинок і в’язкості рідини, а NA – універсальна фізична константа, число Авогадро.
5. Броунівський рух у математиці
У математиці броунівський рух розглядається як один із прикладів Вінерівських процесів. У фізиці він описується рівнянням Ланжевена
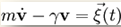
де m — маса частки V — її швидкість, γ — коефіцієнт в'язкості, а — випадкова сила.У дуже в'язкому середовищі інерційним членом можна знехтувати й отримати для зміщення x:
Оскільки
сили, які діють на частинку випадкові, то в середньому вона перебуватиме на
місці.
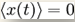
Середньо-квадратичне
зміщення визначається формулою
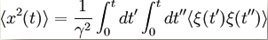
Вираз
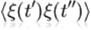 , який потрібно
проінтегрувати, називається кореляційною функцією. Залежність кореляційної
функції від часу визначає тип випадкового процесу. Найпростішим типом випадкового
процесу є Марківський процес. Із загальних міркувань зрозуміло, що кореляційна
функція для випадкових процесів повинна дорівнювати нулю, якщо інтервали часу дуже
сильно відрізняються, оскільки випадкові сили, які діють на частинку в далекі
один від іншого моменти часу, зовсім не узгоджені між собою. Коли температури близькі,
сили можуть бути узгодженими - стан рідини зберігатиметься певний час. Однак
задача про броунівський рух розв'язується особливо просто, якщо взяти
кореляційну функцію в найпростішому вигляді
, який потрібно
проінтегрувати, називається кореляційною функцією. Залежність кореляційної
функції від часу визначає тип випадкового процесу. Найпростішим типом випадкового
процесу є Марківський процес. Із загальних міркувань зрозуміло, що кореляційна
функція для випадкових процесів повинна дорівнювати нулю, якщо інтервали часу дуже
сильно відрізняються, оскільки випадкові сили, які діють на частинку в далекі
один від іншого моменти часу, зовсім не узгоджені між собою. Коли температури близькі,
сили можуть бути узгодженими - стан рідини зберігатиметься певний час. Однак
задача про броунівський рух розв'язується особливо просто, якщо взяти
кореляційну функцію в найпростішому вигляді

де δ(t) - дельта-функція Дірака, а α -
стала, що повинна бути визначена з фізичних міркувань. З фізичної точки зору це
припущення відповідає тому, що рідина миттєво забуває про свій стан.
Підставивши кореляційну функцію в такому вигляді в формулу для середнього
квадратичного зміщення, можна провести інтегрування, отримавши підтвердження
того, що середнє квадратичне зміщення броунівської частинки пропорційне часу.
6.
Дифузія
Дифузія - одна із стадій численних технологічних процесів (адсорбції, сушки, екстрагування,
брикетування зі зв’язуючими тощо). Дифузія відбувається в газах, рідинах і твердих
тілах. Механізм дифузії в цих речовинах істотно різний. Дифузія що відбувається
внаслідок теплового руху атомів, молекул, - молекулярна дифузія. Дифундувати
можуть як частинки сторонніх речовин (домішок), нерівномірно розподілених у
середовищі, так і частинки самої речовини середовища. У останньому випадку
процес називається самодифузією. Термодифузія - це дифузія під дією градієнта
температури в об'ємі тіла, бародифузія - під дією градієнта тиску або гравітаційного
поля. Перенесення заряджених частинок під дією зовнішнього електричного поля - електродифузія.
У рухомому середовищі може виникати конвекційна дифузія, при вихровому русі
газу або рідини - турбулентна дифузія. Наслідком дифузії є переміщення часток
із областей, де їхня концентрація висока, в області, де їхня концентрація
низька, тобто вирівнювання концентрації часток у термодинамічній системі,
встановлення рівноваги за складом. Дифузія дуже розповсюджене явище, яке
відіграє велику роль у функціонуванні живих організмів. У легенях молекули кисню
дифундують у кровоносні судини, завдяки процесам дифузії відбувається обмін
речовин у клітинах. Дифузія
широко використовуються у техніці. Наприклад, робота біполярного транзистора
основана на дифузії неосновних носіїв заряду через p-n перехід. Вибіркове
перенесення певних компонентів у пори речовини - інфільтраційна дифузія.
Дифузія має особливе значення в шахтах, де вона сприяє рівномірному розподілу
шкідливих газів в атмосфері гірн. виробок, попередженню їх небезпечних
скупчень. Суттєве значення відіграє дифузія в технологічних процесах при
застосуванні реагентів.
7.
Рівняння дифузії
Для
опису процесу вирівнювання концентрації часток в термодинамічній системі
використовується рівняння дифузії. В загальному випадку воно є наслідком рівняння
неперервності, яке визначає закон збереження кількості часток.
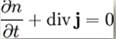
де n -
концентрація часток, j- їхній потік.
Якщо
припустити, що потік часток пропорційний градієнту концентрації з коефіцієнтом
пропорційності D,
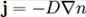
то отримаємо
феноменологічне рівняння дифузії, де
де
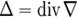 -
оператор Лапласа.
-
оператор Лапласа.
Це рівняння
виражає той факт, що умовою рівноваги за складом є рівність хімічного
потенціалу у всій термодинамічній системі, а вирівнювання концентрації - це
лише частковий випадок для однорідних систем, близьких до ідеального газу.
8.
Осмотичний тиск
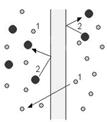
Механізм
виникнення осмотичного тиску
Осмотичний
тиск (або дифузний тиск) - термодинамічний
параметр, що характеризує прагнення розчину понизити свою концентрацію при
зіткненні з чистим розчинником внаслідок зустрічної дифузії молекул розчинника
та розчиненої речовини.
Якщо
розчин відділений від чистого розчинника напівпроникною мембраною, то можлива
лише одностороння дифузія - осмотичне всмоктування розчинника крiзь мембрану в
розчин. У цьому випадку осмотичний тиск стає доступною для прямого вимірювання
величиною, що дорівнює надлишковому тиску, що треба прикласти з боку розчину
для вирівнювання кількості розчинника з обох боків напівпроникної мембрани при
осмотичній рівновазі. Осмотичний тиск зумовлений зниженням хімічного потенціалу
розчинника в присутності розчиненої речовини. Тенденція системи вирівнювати хімічні
потенціали у всіх частинах свого об'єму та переходити до стану з нижчим рівнем вільної
енергії викликає осмотичний (дифузійний) перенос речовин. Осмотичний тиск в ідеальних та сильно
розбавлених розчинах не залежить від природи розчинника та розчинених речовин;
при постійній температурі він визначається тільки числом "кінетичних
елементів" - іонів, молекул, асоціатів або колоїдних часток - в одиниці
об'єму розчину.Перші виміри осмотичного тиску провів В. Пфефер у 1877 році,
досліджуючи водні розчини очеретяного цукру. Його дані дозволили Я. Г.
Вант-Гоффу встановити (у 1887 р.) залежність осмотичного тиску від концентрації
розчиненої речовини, яка збiгаєтся за формою з законом Бойля-Маріотта для ідеальних
газів. Виявилось, що осмотичний тиск чисельно дорівнює тиску, який би завдавала
розчинена речовина, якщо б вона при даній температурі знаходилось в стані
ідеального газу та займала об'єм, що дорівнює об'єму розчину. Для дуже
розбавлених розчинів недисоціюючих речовин знайдена закономірність, що досить
точно описується рівнянням:
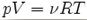
де V- число молей
речовини в розчині об'єму V; R - універсальна газова стала; Т
- абсолютна температура (в Кельвінах), p - величина осмотичного тиску.
У
випадку дисоціації речовини в розчині на іони в праву частину рівняння
вводиться множник і > 1, що називається коефіцієнтом Вант-Гоффа і
відповідає кількості кінетично-активних елементів в розчині; при асоціації
розчиненої речовини і < 1. Так, наприклад, хлорид кальцію CaCl2
при розчиненні дисоціює на три іони, тож для обчислення кількості
осмотично-активних кінетичних елементів (в молях) кількість цієї речовини треба
помножити на три; отже в даному випадку і = 3. Осмотичний тиск реального
розчину (p') завжди менший, ніж ідеального (p"),
причому відношення р' / р" = g, що називається осмотичним
коефіцієнтом, зростає при збільшенні концентрації. Розчини з однаковим
осмотичним тиском називаються ізотонічними або ізоосмотичними. Так,
різноманітні кровезамісники та фізіологічні розчини ізотонічні відносно
серединних рідин організму. Для всіх хребетних тварин (в тому числі і людини)
ізотонічним відносно рідин їхнього організму є 0.9% розчин солі (NaCl) у воді. Якщо
один розчин порівняно з іншим має більш високий осмотичний тиск, його називають
гіпертонічним, а якщо менший осмотичний тиск – гіпотонічним.