Курсовая работа: Адсорбция полимеров на неорганических носителях
СОДЕРЖАНИЕ
СПИСОК
ОБОЗНАЧЕНИЙ И СОКРАЩЕНИЙ
ВВЕДЕНИЕ
1.
Теоретическая часть
1.1
Адсорбция полимеров на неорганических носителях
1.1.1
Теории адсорбции полимеров
1.1.2
Факторы, влияющие на адсорбцию полимеров
1.2
Общая характеристика геллана
1.2.1
Химические свойства
1.2.2
Гелеобразование геллана
2.
Практическая часть
2.1
Методика проведения экспериментов
2.2
Результаты и их обсуждение
3.
ЗАКЛЮЧЕНИЕ
4.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
СПИСОК ОБОЗНАЧЕНИЙ И
СОКРАЩЕНИЙ
Gel
– геллан;
ДМСО – диметилсилоксан;
ДРРЛ
– диффузное рассеивание рентгеновских лучей;
ИЭТ – изоэлектрическая
точка;
НБС – необработанный
Бакланий Северный;
НХ – необработанный
Харасан;
ОБС – обработанный
Бакланий Северный;
ОХ – обработанный
Харасан;
ПАК – полиакриловая
кислота;
ПВА – поливинилацетат;
ПВПД – поли-N-винилпирролидон;
ПДМДААХ – поли-N,N’-диметил-N,N’-диаллиламмоний
хлорид;
ПССН – полистиролсульфонат
натрия;
СЭМ
– сканирующая электронная микроскопия;
ЭДК –
1-этил-3-[3-(диметиламино)пропил]карбодиимид;
ЭХГ – эпихлоргидрин;
ВВЕДЕНИЕ
Адсорбция (от
лат. ad — «на, при» и sorbeo — «поглощаю») – это процесс
поглощения одного вещества (адсорбата) поверхностью другого (адсорбентом).
Процесс проходит
самопроизвольно, в некоторых случаях необратимо.
Выделяют 2 вида
адсорбции: физическую, обратимую, и химическую (хемосорбцию), необратимую,
различающихся по теплотам и энергиям. При определенных условиях адсорбироваться
может любое вещество из жидкой или газовой фазе.
Одним из важнейших
разделов физической химии полимеров в коллоидной химии является физикохимия
поверхностных явлений в полимерах [1].
Это связано с тем, что
создание новых полимерных материалов непосредственно связано с использованием
гетерогенных полимерных систем. Большая часть современных полимерных материалов
является гетерогенными системами с высокоразвитыми поверхностями раздела фаз.
Это - армированные пластики, наполненные термопласты, усиленные резины,
лакокрасочные покрытия, клеи и др.
Адсорбция макромолекул
на поверхности раздела фаз играет большую роль в решении практических проблем в
промышленности, технологии и биологии: адгезии, флокуляции и стабилизации
коллоидных частиц, например.
Характеристики данной
адсорбции различны в сравнении с адсорбцией малых молекул.
Например, количество
конформаций, которые может принимать адсорбированный полимер, термодинамически
возрастает с увеличением длины цепи. На рисунке 1 изображены различные конформации
при адсорбции гибко- и жесткоцепных полимеров.

Рисунок 1 – Различные
конформационные модели при адсорбции полимеров на поверхности: а – цепь
полностью лежит на поверхности; б – коформация петля-цепь-хвост; в – адсорбция
жесткоцепных полимеров (концевая).
Данные конформации в
первую очередь определяются размером и толщиной адсорбированного слоя и только
во вторую очередь энтальпией и энтропией конфигурации. Определение конформации
адсорбированной молекулы играет главную роль в изучении данного процесса.
Адсорбция
макромолекул на твердых поверхностях приводит к ряду изменений в свойствах
полимера. Взаимодействие на границе раздела уменьшает молекулярную подвижность
цепей, что в свою очередь влияет на реологические свойства полученного
материала.
При синтезе полимеров
на твердой поверхности процесс адсорбции существенным образом может повлиять на
кинетические условия реакции, а в некоторых случаях и на структуру (при синтезе
трехмерных пространственных сеток, например).
Адсорбция является
важной стадией гетерогенного катализа. Катализ полимер-протектированными
наночастицами металлов в данное время получил широкое распространение среди
каталитиков. Данный вид катализа содержит в себе признаки трех основных видов:
гомогенного (получение из обычных растворимых соединений металлов, способность
функционировать в мягких условиях), гетерогенного (протекание реакций на
границе раздела фаз, активация субстрата происходит путем адсорбции на
поверхности, катализатор легко отделим от продуктов, и подлежит регенерации) и
ферментативного катализа (структурное соответствие, благоприятная ориентация
реагирующих молекул, дополнительная активация субстрата каталитической
системой). Для получения стабильного, регенерируемого катализатора необходимо,
чтобы полимер прочно был связан с подложкой. Правильные выводы в данном
направлении возможно сделать лишь после изучения всех составляющих параметров
адсорбции полимера.
В мировой практике
извлечения нефти ведутся разработки, направленные на увеличения нефтеотдачи
пластов. Наиболее перспективным методом является метод полимерного заводнения
[2-3].
Применение полимеров
для повышения нефтеотдачи пластов основано на способности их водных растворов,
даже при низкой концентрации полимера, значительно снижать соотношение
вязкостей нефти и воды, анизотропию самого пласта и изменять реологические
свойства и структуру фильтрационных потоков пластовых флюидов. Водорастворимые
полимеры улучшают нефтеотдачу путем увеличения эффективного охвата водной фазы.
Это достигается путем снижения подвижности водной фазы или увеличения вязкости
водной фазы. Адсорбция полимера на пористой породе является причиной снижения
концентрации полимера в водной фазе и, следовательно, снижение вязкости.
1. Теоретическая часть
1.1 Адсорбция
полимеров на неорганических носителях
1.1.1 Теории адсорбции
полимеров
В 1953 году Фриш, Сима
и Ирих одними из первых исследовали изменение в конформациях при
соприкосновении Гауссовских цепей с поверхностью и просчитали термодинамические
характеристики адсорбционного слоя, а также построили изотерму адсорбции (FSE
изотерму). Данные расчеты позволили сделать важный вывод: толщина
адсорбционного слоя (q) в точки θ пропорциоальна квадратному корню из
молекулярной массы полимера (Mp):
qθ
= Mp1/2
Позже в начале 60 годов
ХХ века данное предположение было оспорено Силбербергом и Димарцио, которые
показали, что Фриш и др. не приняли во внимание различные конформации
адсорбированной цепи. Димарцио и Маккрекин показали, что для правильного расчета
числа конформаций адсорбция должна проходить одностадийно.
В середине 60 годов
начались широкомасштабные изучения адсорбции полимеров. На ранних стадиях
исследования основными направлениями являлись конформации изолированных цепей,
распределение петлей, цепей и хвостов, и различная толщина адсорбированных
макромолекул, их статистическое распределение и в это же время стал
использоваться метод компьютерного моделирования под названием «метод Монте
Карло» [4].
При огромном количестве
теоретической базы по данной тематике, практических работ было немного, т.к.
экспериментально доказать, что полимерные цепи адсорбируется изолированно было
не возможно.
Главный интерес в
исследованиях представляла собой взаимосвязь между поглощающей способностью
(масс.%) (А), степенью адсорбции (количество сегментов на одном участке) (Г),
различием сегментов в цепях (р) и толщины адсорбционного слоя с такими
физическими величинами, как молекулярный вес полимера и параметрами
термодинамического взаимодействия между полимером и растворителем и между
адсорбирующей полимер поверхностью. Были попытки сформулировать теорию
адсорбции полиэлектролитов и теорию отслаивания [5].
В 1955 году
гидродинамическим методом была измерена толщина адсорбционного слоя, в 1961
году с помощью инфракрасной спектроскопии впервые определили параметр р, а
разработанный метод эллипсометрии в 1963 году позволил одновременно вычислять поглощающая
способность и толщину слоя.
До конца 70 годов не
было ни одной полноценной теории адсорбции полимеров, а параметры из
существующих теорий нельзя было сопоставить с экспериментальными данными.
Широко известно, что
свободносочлененная полимерная цепь в идеальном растворителе ведет себя как
статистический клубок. При адсорбции такого полимера происходит изменение его конформации.
Часть сегментов цепи непосредственно связывается с поверхностью (цепь), а
оставшиеся сегменты вытягиваются в растворе (петли и хвосты) (см. рис.1). Если
сегмент берет начало на поверхности, то формация «хвост» более выгодна
термодинамически, чем формация «петля» [6].
Существует несколько
теорий, описывающих адсорбцию неионных полимеров. Первую из них предложил Хов.
Он предполагал, что полимерные цепи имеют достаточно большую длину и концевой
эффект (формация «хвост») может не рассматриваться, и покрытие поверхности так
мало, что взаимодействием между адсорбированными цепями можно пренебречь.
Уравнение изотермы
адсорбции выглядит следующим образом:
Na/Sδ = (Nf/V)exp(-λn),
где Na
– количество адсорбированного полимера, S
– площадь поверхности, δ
– толщина первого слоя (слоя «цепь»), Nf
– количество неадсорбированного полимера, V
– объем растворителя, n
– общее количество сегментов в полимерной цепи, λ
–
константа, определяемая графически исходя из графика ln(Na/Sδ)
– ln(Nf/V).
В термодинамически хорошем растворителе при уменьшении (-λ)
и при увеличении фракции адсорбированных сегментов средний размер петель
уменьшается.
Силберберг использовал
модель псевдокристаллической решетки при описании адсорбции гибкоцепных
полимеров. Он предположил, что если цепь адсорбированного полимера с числом
сигментов Р состоит из msi цепей с длинной i и mBi
петлей с длинной i, то общее число конфигураций цепи будет равно:
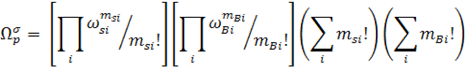
где 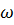 si
и
si
и
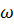 Bi
– число возможных конфигураций цепей и петлей соответственно, зависящие от
свойств растворителя.
Bi
– число возможных конфигураций цепей и петлей соответственно, зависящие от
свойств растворителя.
Данная теория не приводит
аналитических выражений для изотермы адсорбции и для определения толщины
адсорбционного слоя. Силберберг установил, что размер петель в точке θ
приблизительно пропорционален квадратному корню из молекулярной массы полимера
в широком диапазоне, но необходимо вводить дополнительную константу при больших
значениях последних.
Следующая теория носит
название теории Шойдженса и Флира. По их представлениям, адсорбированная
полимерная цепь также состоит из сегментов, помимо этого в системе присутствуют
растворенные молекулы, а адсорбционная поверхность разделена на слои, состоящие
из решеток и расположеные параллельно поверхности.
Расчет изотермы
адсорбции:
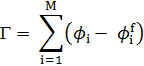
где ϕi
– объем фракции адсорбированных цепей, ϕif
– объем фракции неадсорбированных цепей в i-ом слое.

Рисунок 2 – Изотерма
адсорбции по Шойдженсу и Флиру.
Изотерма адсорбции по
Шойдженсу и Флиру аналогична изотерме Лэнгмюра для небольших молекулярных масс,
для высоких масс они идентичны. Зависимость Г от молекулярной массы подтверждается
теориями Силберберга и Хова.
Шойдженс и Флир
вычислили концентрационное распределение петель и хвостовых сегментов, среднеквадратичную
толщину адсорбционного слоя, а также длины trains, петель и хвостов.
Дженс рассматривал
адсорбцию гибкоцепных полимеров на плоской поверхности из хорошего растворителя
с помощью теории отслаивания. В теории отдельно были рассмотрены 3 режима:
разбавленный, полуразбавленный и стабилизированный, для каждого из которых были
рассчитаны изотермы адсорбции и толщина адсорбционного слоя с использованием
химического потенциала.
1.1.2 Факторы, влияющие
на адсорбцию полимеров
На адсорбцию полимеров
из растворов влияет множество факторов, главные из которых следующие:
1. Влияние
поверхности. Экспериментальные данные по адсорбции полимеров подтверждают тот
факт, что при варьировании адсорбента величина адсорбции изменяется в широких
пределах. Определяющим фактором в данном случае является удельная поверхность
адсорбента: чем выше удельная поверхность, тем лучше адсорбция. Было выявлено [7],
что образцы с близкой удельной поверхностью, но с разными химическими
свойствами, адсорбируют одно и тоже вещество по-разному.
Сравнение адсорбирующей
способности поверхностей осложнено тем, что существуют различные способы
приготовления одного и того же адсорбента, различные методы ее обработки и т.п.
При термической обработке стекла, например, и последующей адсорбции на нем
полидиметилсилоксана заметна существенна разница в адсорбции. Из рисунка 3 видно,
что адсорбционное взаимодействие адсорбата с  обработанным
адсорбентом будет намного прочнее, чем с необработанным.
обработанным
адсорбентом будет намного прочнее, чем с необработанным.

б
Рисунок 3 – Схема
адсорбции полидиметилсилоксана на необработанной (а) и обработанной (б)
поверхности стекла.
2. Влияние
растворителя. Растворитель определяет размеры макромолекулы в растворе, ее
ассиметрию и, следовательно, возможную ориентацию молекулы на поверхности,
структуру адсорбционного слоя и т.п. Необходимо также принимать во внимание
адсорбцию самого растворителя на поверхности, которая мешает сделать правильные
выводы об адсорбции макромолекулы. Связь между взаимодействием полимера и
растворителя и размерами цепи выражается уравнением Флори-Хаггинса, в основе
которого лежит представление об осмотическом давлении статистического клубка
макромолекулы [1]:
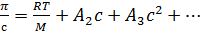 ,
,
где π –
осмотическое давление, с – концентрация раствора, М – молекулярный вес, Аn
– вириальные коэффициенты. Второй вириальный коэффициент характеризует энергию
взаимодействия молекул полимера и растворителя (и может являться
термодинамическим критерием вязкости растворителя наряду с параметром χ из
теории Флори-Хаггинса). При уменьшении данного коэффициента происходит
уменьшение осмотического давление, что влечет за собой уменьшение размеров
макромолекулы и, как следствие, уменьшение вязкости раствора. Таким образом,
вязкость связана с термодинамическим качеством растворителя.
В разбавленных растворах
полимеров в плохих растворителях макромолекулы имеют свернутые формации
(меньшие размеры) и адсорбируются в лучшей степени, чем из хороших
растворителей. В концентрированных растворах помехой адсорбции является еще и
взаимодействие полимер-полимер.
3. Влияние
температуры. Однозначного ответа на данный вопрос в литературе нет. При
рассмотрении влияния температуры следует вкупе учитывать особенности самой
системы. В одних случаях при повышении адсорбции будет способствовать улучшению
термодинамического качества растворителя, в других – к ухудшению. Так как
качество растворителя неоднозначно влияет на адсорбцию, то и зависимость
адсорбции от температуры будет сложной. Под действием температуры также меняет
взаимодействие адсорбент-растворитель.
Установлено, что
адсорбция полиэфира [8-9] и сополимера стирола с бутадиеном [10] с ростом
температуры уменьшается. В то же время обнаружено, что адсорбция полиметакриловой
кислоты на оксиде алюминия [11], синтетического каучука СКН-26 на оксиде железа
[12], полиизопропилакрилата на кременеземе [13], эпоксидной смолы ЭД-6 на белой
саже [14] с повышением температуры, наоборот, увеличивается из-за ухудшения
термодинамического качества растворителя. В работах обращается внимание также
на возможность изменения степени агрегации макромолекул с изменением
температуры.
4. Влияние
молекулярного веса. Скорость адсорбции молекул меньшего размера больше скорости
адсорбции молекул большего размера, т.к. первая обуславливается диффузией.
Поэтому из растворов сначала адсорбируются молекулы меньшего размера, которые
потом вытесняются с поверхность большими молекулами. Но при большой прочности
адсорбционных связей такое вытеснение может и не происходить. Также адсорбция
больших молекул может быть затруднена на пористых адсорбентах (размер пор
попросту может не совпадать с размером молекулы).
В работе [15] адсорбция
катионного полиэлектролита сополимера стирола с диметиламинопропилмалеимидом
разной молекулярной массы на отрицательно заряженной поверхности рассчитана по
изменению заряда и потенциала поверхности методом капиллярной электрокинетики.
Исследования показали, что структура адсорбционного слоя зависит от
молекулярной массы полиэлектролита и его концентрации в объеме, а также от
конформации макромолекул в растворе.
При адсорбции на
непористых сорбентах между максимальной адсорбцией и молекулярным весом
существует зависимость:
AS
= KMα
где К и α –
константы.
Уравнение позволяет
оценить конформацию адсорбированной полимерной цепи. Коэффициент α
уменьшается с ростом молекулярного веса полимера, что свидетельствует о смене
конформаций на поверхности от свернутой к плоской.
1.2 Общая
характеристика геллана
1.2.1 Химические
свойства
Геллан был открыт
сравнительно недавно, в 1977 году. Получают его путем ферментации,
провоцируемой бактерией Sphingomonas elodea. При производстве толщина и
твердость геля геллана варьируются с помощью изопропилового спирта. Природный
геллан имеет 2 ацильных заместителя в глюкозном остатке. При повышенной
температуре и в щелочной среде происходит деацелироване. Такой деацелированный
геллан (часто в литературе просто «геллан») используется в пищевой
промышленности как гелеобразующий агент и модификатор структуры [16].
Молекулярная масса
геллана составляет 70000 дальтон, при этом 95% от массы превышает 500000 дальтон.
По химическому строению геллан является внеклеточным гетерополисахаридом.
Повторяющееся звено в макромолекулярной структуре состоит из остатков 4
полисахаридов: 2х β-D-глюкоз, β-D-глюкуроновой кислоты и α-L-рамнозы
[17]:
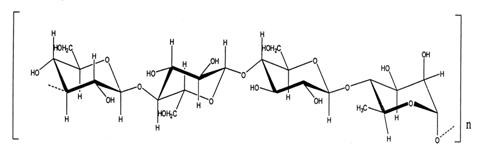
Рисунок 3 – Строение
звена деацелированного геллана.
Между собой
тетрасахаридные фрагменты соединены α 1→3 гликозидными связями.
Примерный состав: 60 % глюкозных остатков, 20 % остатков от рамнозы и 20 % от
глюкуроновой кислоты.
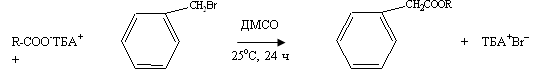
Карбоксильная группа в
глюкуроновой кислоте проявляет все характерные реакции карбоновых кислот, но
при несколько отличных условиях. Например, можно получить бензиловый эфир, если
проводить реакцию с использованием тетрабутиламмониевого производного
природного геллана в реакции взаимодействия с бензилбромидом в
диметилсульфоксиде [18]:
Сшитый геллан способен
набухать в воде, но не растворяется полностью. Сшивающими агентами могут
служить, например, ЭХГ, ЭДК. Ниже приведена реакция сшивания с ЭХГ:
 Gel–OH + CH2–CH–CH2–Cl
→ Gel–O–CH2–CH(OH)–CH2–Cl + NaOH →
Gel–OH + CH2–CH–CH2–Cl
→ Gel–O–CH2–CH(OH)–CH2–Cl + NaOH →
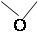 → Gel–O–CH2–CH–CH2
+ NaCl + H2O
→ Gel–O–CH2–CH–CH2
+ NaCl + H2O
+
Gel–OH
↓
Gel–O–CH2–CH(OH)–CH2–O–Gel
1.2.2 Гелеобразование
геллана
При образовании геля
геллана возникают упорядоченные области (блоки), состоящие из параллельных рядов
[19-20]:
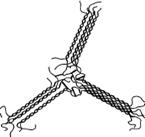
а

б
Рисунок 4 – Самосшитый
геллан: а – связь двойных цепей в агрегаты, б – молекулярная модель гидрогеля (характеристики
блока: длина 12,48 нм; ширина 4,05 нм; высота 8,46 нм).
Механизм
гелеобразования геллана является предметом многих дискуссий. Тем не менее, есть
схожее мнение, что при повышенной температуре происходит термообратимый
конформациооный переход из одинарной структуры в двойную, более упорядоченную [21].
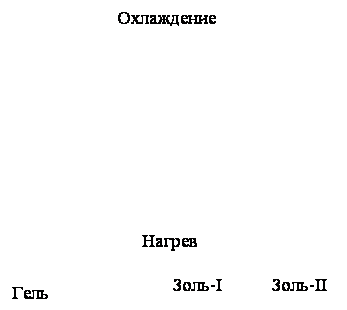
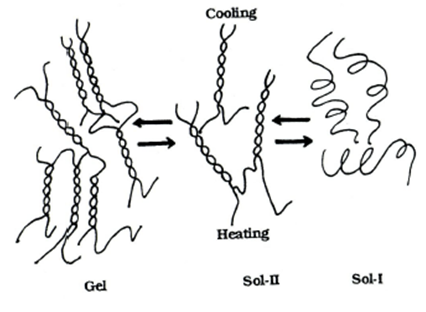
Рисунок
5 – Схематическое представление золь-гель перехода геллана в отсутствие и
присутствии моновалентных катионов.
При высокой температуре
макромолекулы геллана существуют в виде расплетенных единичных клубков (золь-I).
При охлаждении цепи геллана ассоциируются с образованием двойной спирали и
упорядоченной структуры. Однако такая упорядоченная структура еще не приводит к
образованию сетки (золь-II).
Гелеобразование имеет место только в присутствии катионов. Это связано с тем,
что температура фазового золь-гель перехода становится ниже температуры
конформационного перехода спираль-клубок. Однако для геллана, который проявляет
два отдельных перехода (золь-I,
золь-II и гель) не характерен
термический гистерезис при охлаждении и нагревании . Разница между температурой
перехода спираль-клубок и золь-гель уменьшается с увеличением концентрации
добавленной соли. Водный раствор геллана переходит в гель
при температуре 30-35°С [22], который плавится при 90 °С.
По наличию ацильных
групп геллан бывает 2х форм: низкоацильный и высокоацильный. Из высокоацильной
формы получаются очень эластичные и не хрупкие гели, а из низкоацильной –
твердые, хрупкие и неэластичные[23].
Как уже отмечалось
выше, в присутствии катионов геллан превращается в гель [24-25]. Например,
гелеобразование в присутствии катионов натрия используется для определения
молекулярной массы геллана. Катионы Nа+
препятствуют нежелательной агрегации и микрогелеобразованию, что является
основными проблемами при определении молекулярной массы. Бивалентные катионы благоприятствуют
образованию двойной спирали [26].
Добавление
хелатирующих агентов к раствору геллановой камеди увеличивает температуру
гелеобразования, но ухудшает реологические свойства полученного геля [27].
Геллан в данное время
производится компанией Kelco
в Японии и США. Продукт имеет 4 вида и выпускается под названиями: Келкогель
(геллановая камедь), Гельрит (с ионами К+), Фитогель и Гель-Гро [17]
. Келкогель используется в пищевой промышленности в качестве загустителя,
эмульгатора и стабилизатора. В номенклатуре добавок его номер Е418. Остальные 3
вида используются в микробиолигии как альтернатива агар-агару. Геллан выдерживает
температуру до 120оС, что делает его незаменимым при культивации
термофильных организмов.
2 Экспериментальная
часть
2.1 Методика проведения
эксперимента и расчеты
Керны были
предварительно просеяны и разделены по следующим фракциям: 2 мм, 1мм, 500 мкм,
250 мкм, 125 мкм, 45 мкм и меньше 45 мкм. Для работы были выбраны пески Харасан
с размерами частиц 45 и 125 мкм. Для активации поверхности одну часть керновых
материалов промывали горячей соляной кислотой (HCl),
затем многократно дистиллированной водой для удаления следов HCl.
Вторую часть использовали без предварительной промывки для сравнительных целей.
Фракционирование
сорбентов осуществляли на приборе Type
AS 200 control
(Германия).
Размеры частиц и
структуру поверхности частиц оценивали с помощью низковакуумного растрового
электронного микроскопа JEOL
JSM – 6490LA
(Япония). Качественный и количественный анализ состава керна проводили на
рентгеновском дифрактометре X’Pert
MPD PRO
(PANalytical, Голландия).
Кондуктометрическое титрование
полимеров проводили на рН/кондуктометре «Mettler Toledo MPC 227» (Швейцария)
при комнатной температуре. Кинетику адсорбции изучали по методике, описанной в
работе [28]. Керн в количестве 10г загружали в коническую колбу объемом 250 мл
с раствором полимера известной концентрации. Кинетику адсорбции изучали при
постоянном перемешивании при комнатной температуре. В определенный момент
времени перемешивание останавливали и отбирали 5 мл раствора полимера, который
затем центрифугировали и определяли его концентрацию методом
кондуктометрического титрования. Концентрацию адсорбированного полимера
вычисляли по формуле:
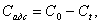
где
C0 – исходная концентрация полимера в растворе, моль/л;
Ct
- равновесная концентрация полимера, оставшегося в растворе в момент времени t,
моль/л;
Cадс
– концентрация адсорбированного керном полимера, моль/л.
Равновесную
концентрацию полимера Ct
определяли кондуктометрическим титрованием водного раствора определенной
концентрации из состава поликомплекса.
Величину сорбции [29]
рассчитывали по формуле:
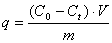 ,
,
где
C0 – исходная концентрация полимера в растворе, моль/л; Ct
- равновесная концентрация полимера, оставшегося в растворе в момент времени t,
моль/л; V – общий объем
раствора, л; m – масса сорбента, г.
Для обработки кинетики
сорбции геллана использовали три модели, описывающие процессы адсорбции на
границе раздела фаз “твердое тело - жидкость”.
Изотерму адсорбции на
неоднородной поверхности определяли по Фрейндлиху [30]:
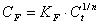
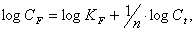
где СF
– концентрация сорбированного полимера;
Ct
- равновесная концентрация полимера, оставшегося в растворе в момент времени t;
KF
и 1/n – константы,
определяемые отрезком на оси ординат, отсекаемым касательной, проведенной к
начальному участку кривой, и углом наклона, соответственно.
Изотерма Темкина [30]
описывает линейную зависимость:
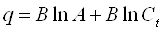 ,
,
где А и B
–
константы Темкина.
Изотерма Лэнгмюра [30]
для мономолекулярного слоя описывается следующей формулой:

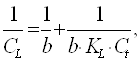
где
b – максимальное количество
адсорбированного полимера;
KL
– константа, определяемая из угла наклона начального участка изотермы.
2.2 Результаты и их
обсуждения
Для определения
количества адсорбированного полимера на кернах использована реакция
комплексообразования между комплементарными макромолекулами.
При этом состав
образующихся полимер-полимерных комплексов определен кондуктометрическим титрованием
одного полимера другим.
Полимер-полимерные
комплексы содержат цепи, состоящие из комплементарных макромолекул, и являются
устойчивыми макромолекулярными соединениями, свойства которых отличаются от
свойств исходных полимеров.
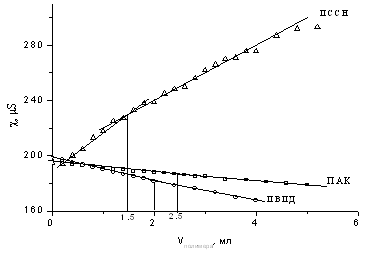
Рисунок 6 – Кондуктометрическое
титрование 20 мл геллана (С = 1,5·10-3 М) растворами полимеров
Из рисунка 6 видно, что
точка перегиба кривой приходится на объем ПАК V=2,5
мл, то есть для того, чтобы оттитровать 1 мл геллана требуется 2,5 мл 2,5·10-2
моль/л ПАК. Это, в свою очередь, свидетельствует об образовании комплекса
состава [ПАК]:[геллан]=1:1. В дальнейшем, исходя из состава поликомплекса по
формуле: 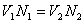 , где V1
и N1
объем (мл) и концентрация (моль/л) полимера-1, V2
и N2
объем
(мл) и концентрация (моль/л) полимера-2 ушедшего на титрование определяли
концентрацию полимера-2. Разница между исходной концентрацией полимера и
найденной кондуктометрическим титрованием концентрацией дает концентрацию
адсорбированного полимера. Керн представляет собой цилиндрическую колонку
плотной горной породы. На рисунке 7 представлены фотографии цельных (а) и
измельченных керновых материалов (б, в).
, где V1
и N1
объем (мл) и концентрация (моль/л) полимера-1, V2
и N2
объем
(мл) и концентрация (моль/л) полимера-2 ушедшего на титрование определяли
концентрацию полимера-2. Разница между исходной концентрацией полимера и
найденной кондуктометрическим титрованием концентрацией дает концентрацию
адсорбированного полимера. Керн представляет собой цилиндрическую колонку
плотной горной породы. На рисунке 7 представлены фотографии цельных (а) и
измельченных керновых материалов (б, в).



а б в
Рисунок 7 – Внешний вид
керновых материалов
Данные по качественному
и количественному составу кернов показывают, что керн из месторождения Харасан
содержит оксида кремния SiO2
80-90%. Помимо оксида кремния в составе керна встречаются и другие соединения,
но в меньших количествах: Ca(OH)2,
Al2O3,
Al2SiO5,
FeO, MgO,
Mg2Si2O6,
Na[AlSi3O8],
KFeO и другие.
С помощью сканирующего
электронного микроскопа проведен элементный анализ всех исходных кернов
(Рисунок 8).
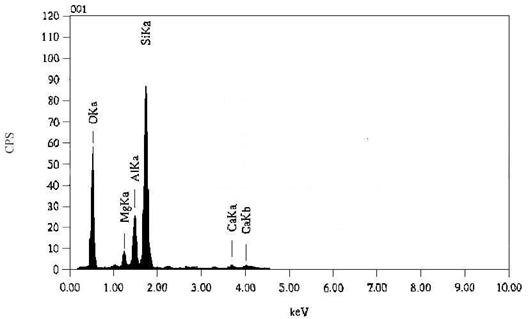
Рисунок 8 – Элементный
анализ исходного керна с месторождения Бакланий Северный
Как видно из рисунка 8,
состав керна состоит в основном из кремния и кислорода в виде оксида кремния (IV).
В состав керна также входят соединения оксидов алюминия, магния и кальция.
Для керна с
месторождения Харасан проведены аналогичные исследования. Обнаружено, что
основным соединением, составляющим керн, является диоксид кремния. Также в
состав керна входят соединения алюминия, натрия, углерода и в небольших
количествах обнаружены железо, калий.
На рисунке 9 приведены
микрофотографии керна месторождения Харасан до и после процесса адсорбции
геллана. Видно, что после адсорбции поверхность керна покрыта колониями
геллана.


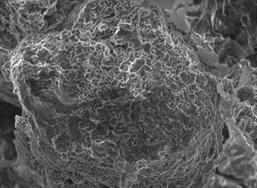
Рисунок 9 –
Микрофотографии структуры поверхности предварительно необработанного керна с
месторождения Харасан «до» (А) и «после» (Б) адсорбции геллана (увеличение в
700 раз)



Рисунок 10 –
Микрофотографии структуры поверхности керна с месторождения Бакланий Северный «до»
(А) и «после» (Б) активации поверхности горячей 1 н HCl
Изменения в структуре и
составе керна после промывки его горячей соляной кислотой подтверждаются и
данными рентгенофазового анализа. Из рисунка 11 видно появление новых, и
уменьшение интенсивности других фаз. Это, по-видимому, обусловлено удалением из
поверхности частиц керна пленок и различных микропримесей, а также химической
модификацией поверхности.
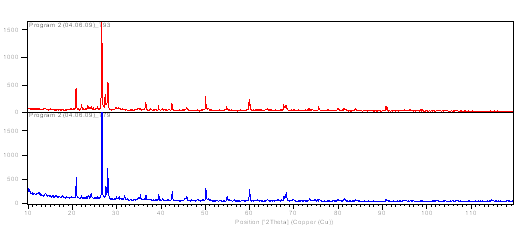
Рисунок 11 –
Рентгеновская дифрактограмма керна из месторождения Харасан «до» (779) и «после»
(793) активации поверхности горячей HCl
Известно,
что адсорбция полимеров на поверхности обуславливается как электростатическими,
так и специфическими химическими силами [31]. На рисунке 12 представлены
графики зависимости концентрации адсорбированного на кернах полимеров от
времени контакта.
Скорость
адсорбции полимеров зависит от молекулярной массы полимера и типа адсорбента.
Для непористых адсорбентов характерно быстрое установление равновесия.
Поскольку используемые в работе керны не содержат пор, а только лишь
шероховатости на поверхности, то и в нашем случае адсорбция протекает очень
быстро – в течение нескольких минут.
На
рисунке 12 видно, что на предварительно активированном HCl
керне сорбируется большее количество геллана, поскольку создание дополнительных
активных центров способствует лучшей адсорбции полимера.

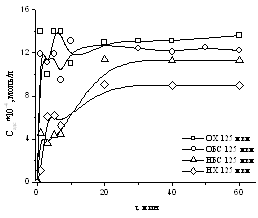
Рисунок 12 – Кинетика
адсорбции геллана на поверхности кернов. СGel=1,5·10-3
моль/л, Т=298К
Также
наблюдается некоторое падение значения концентрации адсорбированного полимера
после насыщения.
Из
литературных данных известно [30], что с кинетической точки зрения адсорбция
является обратимым процессом, то есть одновременно с адсорбцией происходит и
десорбция.
В
начале процесса скорость адсорбции больше, чем скорость десорбции.
По
мере насыщения поверхности адсорбента устанавливается состояние адсорбционного
равновесия, которое характеризуется равенством скоростей адсорбции и десорбции.
При
адсорбции геллана на 125 фракциях десорбция не наблюдается. Из этого следует,
что геллан прочнее держится на более крупных частичках керна, что связано, с
его высокой молекулярной массой и строением звена. Тогда как с более мелких
частичек смыть полимер гораздо легче.
На рисунке 13 приведены
адсорбционные емкости обработанного керна месорождения Харасан.
Адсорбционная емкость
керна показывает, какое количество полимера адсорбируется на 1 г керна. Из графика
видно, что 125 фракция Харасана проявляет большую способность адсорбировать
геллан.

Рисунок
13 – Сорбционные емкости керна с месторождения Харасан
Адсорбция
геллана на поверхности керна из месторождения Харасан протекает эффективнее,
чем на поверхности керна месторождения Бакланий Северный. Это, по-видимому,
связано с большим содержанием оксида кремния (80-90%) на поверхности керна из
месторождения Харасан, чем керн из месторождения Бакланий Северный (30-40%).
Поскольку единой
теории, достаточно корректно описывающей все виды адсорбции на разных
поверхностях раздела фаз, пока не существует, то для обработки кинетических
кривых адсорбции нами использованы некоторые наиболее распространенные теории,
описывающие отдельные типы адсорбции на поверхности раздела «твердое тело –
раствор».
Модели
Фрейндлиха и Темкина учитывают, что поверхность керна неоднородна, между
адсорбированными частицами имеет место взаимодействие, а активные центры не
являются полностью независимыми друг от друга [32]. Тогда как в теории
мономолекулярной адсорбции Лэнгмюра имеется ряд допущений, которые в
значительной степени идеализируют и упрощают процессы, протекающие при
адсорбции.
На рисунках 14-16
приведены графики, полученные с использованием вышеприведенных уравнений. Все
точки изотерм Фрейндлиха лежат в одной области, поэтому на графике приведены
только изотермы для модифицированных поверхностей. Из изотерм Фрейндлиха хорошо
видно, что количество адсорбированного геллана больше для модифицированной
поверхностей Харасана для 45 фракции и для Баклания Северного для 125 фракции.
Все точки в этих моделях хорошо ложатся на прямую линию. Следует отметить, что
все три модели изотерм адсорбции также подтверждают утверждение о лучшей
адсорбционной способности керна месторождения Харасан.
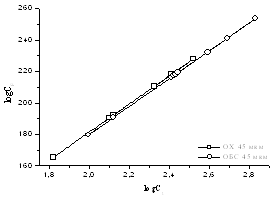
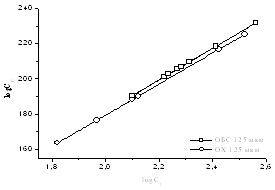
Рисунок 14 – Изотермы
адсорбции геллана, полученные по уравнению Фрейндлиха, для модифицированных
поверхностей кернов.
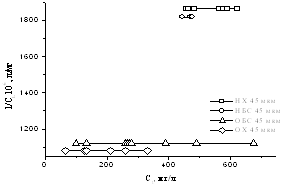
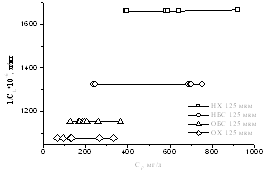
Рисунок 15 – Изотермы
адсорбции геллана, полученные по уравнению Лэнгмюра.
Наклон изотерм Лэнгмюра
говорит сам за себя: полученные прямые доказывают, что данная модель не
применима для описания процессов адсорбции геллана на керновых материалах.
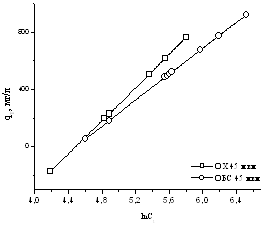
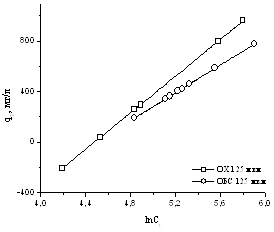
Рисунок 16 – Изотермы
адсорбции геллана, полученные по уравнению Темкина, для модифицированных
поверхностей кернов.
Таким образом, была
изучена адсорбция геллана на непористых сорбентах неорганического
происхождения. Полученные константы уравнениий Лэнгмюра, Фрейндлиха и Темкина
приведены ниже в таблице.
Таблица 1 – Константы
изотерм Фрейндлиха, Лэнгмюра и Темкина для геллана.
| Наименование
керна |
Наименование
модели и константы |
| Фрейндлих |
Темкин |
Лэнгмюр |
| KF,
мг/л |
1/n |
KL,
мг/л |
b,
мг/л |
В,
мг/л |
А,
л/мг |
| НХ
45 мкм |
312,71 |
88,5374 |
88,5374 |
536,22 |
312,71 |
0,01129 |
| ОХ
45 мкм |
583,81 |
89,3448 |
89,3448 |
927 |
583,81 |
0,01119 |
| НБС
45 мкм |
434,3 |
89,0079 |
89,0079 |
549 |
434,3 |
0,01123 |
| ОБС
45 мкм |
455,23 |
88,6386 |
88,6386 |
894 |
455,23 |
0,01128 |
| НХ
125 мкм |
269,65 |
88,2936 |
88,2936 |
602 |
269,65 |
0,01133 |
| ОХ
125 мкм |
726,44 |
88,2623 |
88,2623 |
926,8 |
726,44 |
0,01133 |
| НБС
125 мкм |
204,07 |
86,2645 |
86,2645 |
755 |
204,07 |
0,01159 |
| ОБС
125 мкм |
551,24 |
89,4410 |
89,4410 |
867 |
551,24 |
0,01118 |
Полученные результаты
представляют интерес для дальнейшей работы по изучению полимер-протектированных
катализаторов на основе геллана.
ЗАКЛЮЧЕНИЕ
1.
Методом
сканирующей электронной микроскопии и рентгенодифрактометрии установлен
качественный и количественный состав кернов.
2.
Опробирована
новая методика определения количества адсорбированных полимеров на поверхности
кернов, суть которой заключается в проведении интерполимерных реакций между
комплементарными макромолекулами. Методом кондуктометрического титрования
определены составы интерполимерных комплексов.
3.
Показано
влияние предварительной активации поверхности на кинетику адсорбции полимера.
Обнаружено, что предварительное промывание керновых материалов
месторождений Бакланий Северный и Харасан горячей соляной кислотой увеличивает
адсорбцию полимеров.
4.
Получены
кинетические кривые адсорбции полимеров на поверхности керновых материалов. Установлено,
что наибольшей сорбционной емкостью обладает керн месторождения Харасан с
размером частиц 125 мкм.
5.
Определены
изотермы адсорбции и константы уравнений Фрейндлиха,
Темкина и Лэнгмюра. Установлено, что изотермы адсорбции
полимеров на поверхности кернов хорошо описывается уравнением Фрейндлиха и
Темкина.
СПИСОК ИСПОЛЬЗОВАННОЙ
ЛИТЕРАТУРЫ
1.
Липатов Ю.С., Сергеева Л.М. Адсорбция полимеров – Киев: Наукова думка. – 1972.
– 195с.
2.
Федорова А.Ф., Шиц Е.Ю., Портягин А.С. Исследование возможности применения
растворов полимеров в качестве агентов вытеснения нефти на месторождениях с
аномально низкими пластовыми температурами // Нефтегазовое дело – 2008. –
С.1-12.
3.
Миловидов К.Н., Т.И. Колчанова. Мировая практика применения методов повышения
нефтеотдачи // Нефтегазопромысловое дело – 2002. – №8. – С.46-48.
4. Doll J., Freeman D. Monte Carlo Methods in
Chemistry // Computing in Science and Engineering, 1994 – V.1. – P.2-32.
5.
Соловьев В.А., Сачко В.Н., Шермергор Т.Д. Теория отслаивания пленок и защитных
покрытий // Поверхность. Физика, химия,
механика,
1982. – №10. – C.51-58.
6. Takahashi A., Kawaguchi M. The structure of
macromolecules adsorbed on interfaces // Advances in polymers science, 1982 – №
46. – P.5.
7. Jada A., Akbour R., Douch J. Surface charge and
adsorption from water onto quarz sand of humic acid // Chemosphere. – 2006. –
V. 64. – P.1287-1295.
8. Ellerstein S., Ullman R. // J. Polym. Sci. –
1961. – V. 55, №161. – P.123-155.
9. Howard G.J., Meconel P. // Ibid. – V.71, №9. –
P.2974-2995.
10. Stromberg R.R., Quasius A.R., Toner S.D., Parker
M.S. // J. Res. Nat. Bura Standards. – 1959. – V.62, №2. –
P.71-77.
11.
Солтыс М.Н., Малеев И.И., Полонский Т.М., Микитюк И.М. Адсорбция
полиметакриловой кислоты на окиси алюминия // Поверхностные явления в
полимерах. Киев: Наукова думка. – 1970. – С.65-70.
12. Gilliland E.R., Guttof E.B. // J. Appl. Polym.
Sci. – 1960. – V. 3, №7. – P.26-42.
13. Botham R., Thies C. // J. Colloid and Interface
Sci. – 1961. – V. 55, №1. – P.1-7.
14.
Тульбович В.И., Приймак Э.М. // Журнал физ. хим. – 1969. – Т. 43, №4. –
С.960-962.
15.
Ермакова Т.Б., Сергеева И.П. Структура и свойства адсорбционных слоев катионных
полиэлектролитов на отрицательно заряженной поверхности // IX Всероссийская
конференция. Структура и
динамика
молекулярных
систем.
– 2002.
16. Nitta Y., Takahashi R., Nishinari K.
Viscoelasticity and phase separation of aqueous Na-type gellan solution //
Biomacromolecules. – 2010. – V.11. – P.187–191
17. Popa M., Bajan N., Popa A.A., Verestiuc L. The
preparation, characterization and properties of catalase immobilized on
crosslinked Gellan // Journal of Macromolecular Science, Part A: Pure and
Applied Chemistry. – 2006. – V.43. – P.355-367.
18. Ishwar B., Shrikant S., Parag S., Rekha S.
Gellan Gum: fermentative production, downstream processing and applications //
Food Technol. Biotechnol. – 2007. – V. 45. – P.341–354.
19. Desideri P., Crescenzi V., Yuguchi Y., Urakawa
H., Kajiwara K .Solution and gelling properties of gellan benzyl esters //
Macromolecules. – 1999. – V.32. – P.7109-7115.
20. Desideri P., Crescenzi V., Yuguchi Y. Synthesis
and physicochemical characterization of gellan gels mariella dentini //
Macromolecules. – 2001. – V.34. – P.1449-1453
21. Tanaka S., Nishinari K. Unassociated molecular
chains in physically crosslinked gellan gels // Polymer Journal. – 2007. –
V.39. – P.397–403.
22. Amici E., Clark A.H., Normand V., Johnson N.B.
Interpenetrating network formation in gellan-agarose gel composites //
Biomacromolecules. – 2000. – V.1. – P.721-729.
23. Shinnosuke K., Yoko N., Katsuyoshi N. Large
deformation analysis of gellan gels // Journal of Applied Physics. – 2007. –
V.102, Is. 4.
24. Urakawa H., Kajiwara K. Conformational
transition of polysaccharide sodium-gellan gum in aqueous solutions //
Technical Evaluation Report Page Compiled by ICF Consulting for the USDA
National Organic Program. – 2006.
25. Atkin N., Abeysekera R.M., Kronestedt-Robards
E.C., Robards A.W. Direct visualization of changes in deacylated Na(+) gellan
polymer morphology during the sol-gel transition // Biopolymers. – 2000. –
V.54(3). – P.195-210.
26. Miyoshi E., Takaya T., Williams P.A., Nishinari
K. Effects of sodium chloride and calcium chloride on the interaction between
gellan gum and konjac glucomannan // J. Agric. Food Chem. – 1996. – V.44. –
P.2486−2495.
27. Camelin I., Lacroix C., Paquin C., Prbvost H.,
Cachon R., Diviest C. Effect of chelatants on gellan gel rheological properties
and setting temperature for immobilization of living bifidobacteria //
Biotechnol. Bog. – 1993. – V. 9. –P.291-297.
28. Sabhapondit A., Borthakur A., Haque I.
Adsorption behavior of poly(N,N-dimethylacrilamide-co-Na
2-acrylamido-2-methylpropanesulfonate) on sand surface // J. of Applied Polymer
Science. – 2004. – V.91. – P.2482-2490.
29.
Пимнева Л.А., Нестерова Е.Л. Изотермы сорбции ионов бария, меди и иттрия на
карбоксильном катионите КБ-4ПХ2. // Современные наукоемкие технологии. – 2008.
– №4. – С.1-5.
30.
Воюцкий С.С. Курс коллоидной химии. Москва:
Химия.
– 1976. – 512с.
31. Sabhapondit A., Borthakur A., Haque I.
Adsorption behavior of
poly(N,N-dimethylacrylamide-co-Na-2-acrylamido-2-methylpropanesulfonate) on
sand surface // Journal of Applied Polymer Science. – 2004. – V.91. –
P.2482–2490.
32. Brandrup J., Immergut E.H. Polymer handbook.
London. – 1975.